本帖最后由 草船借箭 于 2016-7-4 21:26 编辑 : |" P* P5 T9 r
0 W6 R3 P1 [" a0 U
兵马未动,粮草先行:AZD9291的耐药机制在何方?
" y: B: |, h* H2 Q+ m& M9 D
5 G) N' H. L! M) a0 q- k h+ q9 L肿瘤资讯 2015-10-25 11:15:00
; E! {' T8 A. F" ` b" r, Z超过1/3的亚裔非小细胞肺癌(NSCLC)患者存在经典的EGFR基因突变,多个临床试验表明,第一代可逆性的的EGFR-TKIs可以显著地延长伴有EGFR敏感突变的晚期NSCLC患者的无进展生存期(PFS)。但这些患者几乎都在1年内发生耐药。新一代TKI AZD9291的耐药同样不可避免。目前,AZD9291的耐药机制仍知之甚少。为此,来自首尔国立大学的Dae Seog Heo教授在AZD9291耐药后的再活检标本中研究了其耐药机制! [7 i4 d0 q- ], l( l% V% V
+ t0 w# @/ j; ?/ V0 h背景:表皮生长因子受体(EGFR)酪氨酸激酶区基因突变可导致EGFR下游信号通路(包括MARK,PI3K/AKT,JAK/STAT等)的持续活化而促进肿瘤细胞的增殖。超过1/3的亚裔非小细胞肺癌(NSCLC)患者存在经典的EGFR基因突变,即19号外显子缺失及21号外显子L858R突变[1]。多个临床试验表明,第一代可逆性的的EGFR-TKIs可以显著地延长伴有EGFR敏感突变的晚期NSCLC患者的无进展生存期(PFS)。但这些患者几乎都在1年内发生耐药。研究发现,大约50%的第一代EGFR-TKIs耐药是由于EGFR基因20号外显子出现T790M突变。针对这种耐药机制,新一代、突变选择性、不可逆的EGFR-TKIs(包括AZD9291、CO1686等应运而生并显示出可喜的疗效 [2],[3]。然而AZD9291的耐药同样不可避免。目前,AZD9291的耐药机制仍知之甚少。为此,来自首尔国立大学的Dae Seog Heo教授在AZD9291耐药后的再活检标本中研究了其耐药机制 [4]。
( o* }: H) ]' C8 A: v
0 A) K) P) {9 q$ e+ v3 }方法:4个对第一代EGFR-TKIs耐药的患者被证实同时存在19号外显子缺失和T790M突变并参加了一项AZD9291的一期临床试验(NCT01802632,20-80mg/d)。AZD9291耐药后,患者接受再活检。其耐药后的标本用于研究EGFR基因状态变化、旁路激活以及组织学转变。9 i% C) n- K ^! h0 Q; E9 s
- P/ d: s+ _5 F- x$ t2 H6 H
结果:4个患者的最佳疗效均为部分反应(中位反应时间9个月,[范围,9-11月])并最终出现AZD9291耐药。3个患者的耐药肿瘤组织中EGFRT790M突变克隆较耐药前明显下降(<1% vs. 12%-36%):1个患者出现EGFRLREAT747del/T790M双突变克隆消失,2个患者伴随有NSCLC向小细胞肺癌转变和局部FGFR1扩增。第4个患者的耐药肿瘤中EGFR19del/T790M双突变仍然存在,但出现EGFR配体的过表达。
7 d+ r: z. s1 f' }0 R) w1 W0 _) o7 p! F8 l, I0 ~6 _2 W
结论:AZD9291继发耐药的机制可能包括EGFRT790M突变克隆消失伴随旁路激活;肿瘤细胞的组织学转变和EGFR配体依赖的活化。4 u% `8 S+ O0 ?6 C6 G$ x
! o5 g, Y5 T h0 h
小编点评:晚期NSCLC的治疗是精准医疗的范例。10余年前,IPASS研究揭开了晚期NSCLC靶向治疗的序幕。如果把恶性肿瘤比喻成敌人,那么驱动基因犹如敌方粮草。“兵马未动,粮草先行”,断敌“粮草”,就可以扼杀肿瘤。近十年来,我们对NSCLC这个敌人的“粮草”来源研究得越来越清楚(图1),也成功地开发出了断其粮草的武器。但我们的敌人同样非常狡猾,在遭受第一轮“断粮草”的打击后,进化出新的“粮草”来源,发起新一轮的攻势(图2)。可以说,与肿瘤的战争旷日持久,制敌之道在于及时找到其粮草来源。如今,相同的故事又发生在第三代EGFR-TKI这个头上顶着光环的明星小分子身上。当我们还沉浸在第三代EGFR-TKI成功克服第一代EGFR-TKI耐药的喜庆中时,第三代EGFR-TKI的继发耐药已悄然来临。前期一些体外试验发现,第三代EGFR-TKI的耐药机制可能包括MAPK1扩增[5]、继发EGFR C797S突变[6]和RAS信号通路激活[7]。在本研究中,研究者通过分析AZD9291耐药标本的遗传学改变和病理学改变,发现了其潜在的耐药机制。可以看出AZD9291的耐药也不是很新鲜的手段,无非是旁路激活、组织学转变或依赖于EGFR配体的活化。了解这些耐药机制有助于开发特异性的治疗手段。可以看出,在靶向治疗的时代,及时发现“敌方粮草来源”是最关键的一步。而再活检或动态活检及新一代测序技术无疑是获取敌方粮草情报的关键手段吧。# r$ g, ^5 Z" O% n2 l! T# d6 r
/ f0 p$ z4 Y2 |5 H f I: r2 |6 G
& d: P( Q0 U' F# }+ m U8 ^3 Q
0 I) _6 |5 R2 ^' m4 b) i- [图1. 非小细胞肺癌(肺腺癌)的驱动基因示意图。. P V. Y3 L2 t
4 S& ]7 l, F6 X/ j. r7 p. C% ?2 p' t$ e
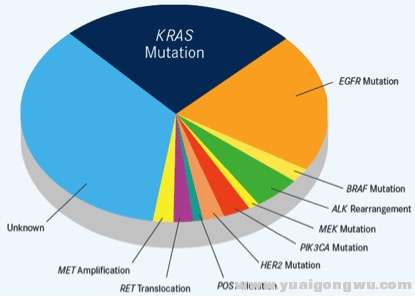
z! U: |( X2 F) j4 j6 g. G/ c V$ r+ k7 {" O- {
a1 C# l3 T" D6 P9 ~& z S3 F+ b; U$ Y8 [$ H4 G" w5 P
图2. 第一代EGFR-TKI的耐药机制模式图。
4 l- d( v+ w! b1 w6 C% ^
2 a) |; n& X1 g n" P
& V# U& d, L) m" J3 V- p% W, ^
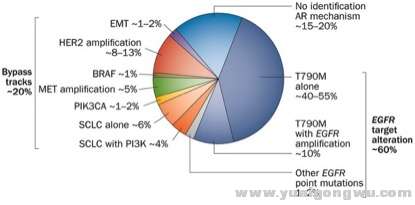 & j3 a9 ~* f8 k! V2 W
& j3 a9 ~* f8 k! V2 W
参考文献" Q7 H( A* t. N: V* d5 u3 W5 _% Y
; V2 v/ b7 e# [. {8 E# d1 V[1]. Hong S, et al. A large-scale cross-sectional study of ALK rearrangements and EGFR mutations in non-small-cell lung cancer in Chinese Han population. Sci Rep. 2014 Dec 1;4:7268. doi: 10.1038/srep07268.
! j- B8 n3 ^) C. C8 @! o+ i' P# W" ~9 f X" V$ B
[2]. Jänne PA, et al. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer.! }2 g2 l d) Q, G
$ w; c9 d, a& Y$ }7 p3 S+ U[3]. Sequist LV, et al. Rociletinib in EGFR-mutated non-small-cell lung cancer. N Engl J Med. 2015 Apr 30;372(18):1700-9. doi: 10.1056/NEJMoa1413654./ t. X- g( d% v% ` h$ P
! u7 u0 U# L! j& w( o; D
[4]. Kim TM, et al. Mechanisms of Acquired Resistance to AZD9291, a Mutation-Selective, Irreversible EGFR Inhibitor. J Thorac Oncol. 2015 Oct 15. [Epub ahead of print]
8 O! R1 ^9 ^/ s2 I! K# L# k, `, X V' f7 R) Q0 O. l( m
[5]. Ercan D, et al. Reactivation of ERK signaling causes resistance to EGFR kinase inhibitors. Cancer Discov. 2012 Oct;2(10):934-47. doi: 10.1158/2159-8290.CD-12-0103.5 T+ |' M, D0 q; E
4 H: H; Q2 E, \[6]. Thress KS, et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nat Med. 2015 Jun;21(6):560-2. doi: 10.1038/nm.3854.- ?7 k3 k" S9 p; \# I6 S( \9 i# A) t
* E' k2 i4 h H. p9 O[7]. Eberlein CA, et al. Acquired Resistance to the Mutant-Selective EGFR Inhibitor AZD9291 Is Associated with Increased Dependence on RAS Signaling in Preclinical Models. Cancer Res. 2015 Jun 15;75(12):2489-500. doi: 10.1158/0008-5472.CAN-14-3167.
1 P- d2 r# s5 I9 O+ Ghttps://www.liangyihui.net/doc/d ... mp;isappinstalled=1 |